Как и другие предметы, атомы могут взаимодействовать друг с другом. Механизм их взаимодействия довольно тяжёл для восприятия, ведь атомы - представители
мира квантовой физики, тогда как мы являемся представителями мира классической физики. Естественно, законы в этих мирах кардинально отличаются друг от друга,
поэтому нам сложно понять атомы, а атомам сложно понять нас /: Однако если захотеть разобраться с этой довольно сложной темой и начать это делать, то всё
получится, а данный сайт постарается помочь вам в этом (:
Существует несколько видов взаимодействия атомов друг с другом. Это обменный и донорно-акцепторный. О них подробнее будет рассказано далее.
Обменный механизм - механизм взаимодействия атомов, в ходе которого у атомов образуется хотя бы 1 общая электронная пара. Это типичный механизм
взаимодействия между атомами, ведь он является наименее энкргозатратным, чем донорно-акцепторный механизм, а также довольно прост в реализации
Обменный механизм взаимодействия атомов - механизм, при котором
Донорно-акцепторный механизм - механизм взаимодействия атомов, в ходе которого один из атомов предоставляет электронную пару и орбиталь, а другой -
только орбиталь. Атом, предоставляющий электронную пару и орбиталь - донор. Атом, предоставляющий только орбиталь - акцептор.

Рассмотрим, например, строение азотной кислоты.
Здесь следует обратить внимание на связи N = O, так как с одним из кислородов связь образована по донорно-акцепторному механизму. Такой вывод можно
сделать на основе оценки количества связей у азота. Здесь их 5, а он может образовывать максимум 4 (по обменному механизму). Следовательно, здесь одна
из связей образована особым способом. В данном случай донором является кислород, а акцептором - азот.
При разборе какого-либо взаимодействия логично предположить, что у него должен быть какой-либо результат. Вопрос заключается в том, как он будет выражен.
В данном случае результат взаимодействия атомов друг с другом - образование связей друг с другом. Если бы этого не происходило, атомы бы не могли бы
образовывать сложные вещества, и мир был бы не таким разнообразным, как сейчас. Возможно, из-за отсутствия сложных веществ человечество не достигло
бы таких результатов, какие мы имеем сейчас, и не развивалось бы дальше, поэтому связи между атомами имеют большое значение в этом мире.
Связи между атомами различаются между собой по длине, своему типу и характеру.
Сигма-связи - связи, которые образуются между атомами путем образования общих электронных пар. Они самые прочные, поэтому они являются "фундаментом",
который "удерживает" атомы рядом друг с другом, поэтому такие связи есть у любых 2 атомов, соединённых друг с другом. Между 2 атомами может образовываться
только 1 сигма-связь!
Пи-связи - связи, которые образуются путём перекрывания электронных облаков у 2 атомов. Они менее прочные, чем сигма-связи, поэтому их легко разорвать.
Между 2 атомами, в отличие от сигма-связей, может образовываться более 1 пи-связи, или их не может быть вообще.
По своему характеру связи делятся на ионные, металлические и ковалентные. Последние в свою очередь делятся на полярные и неполярные. Подробнее эти связи
будут рассмотрены ниже.
Ковалентная связь - связь между 2 атомами неметаллов. В данной связи нет заряженных частиц и других необычных особенностей, однако здесь есть критерий:
полярность связи - характеристика, показывающая распределение электронной плотности по молекуле. Если полярность равна 0, то плотность распределена
равномерно. Такая связь называется ковалентной неполярной. Если полярность связи находится в диапазоне от 0 до 1,7, то такая связь является ковалентной
полярной, а если полярность больше 1,7, то это уже ионная связь.
Ковалентная неполярная связь - связь, показывающая равномерное распределение электронной плотности по молекуле, состоящей из атомов неметаллов.
Следовательно, данная связь есть между атомами одного и того же элемента. Данный вывод можно сделать на основе шкалы Полинга, показывающей
электроотрицательность каждого элемента.
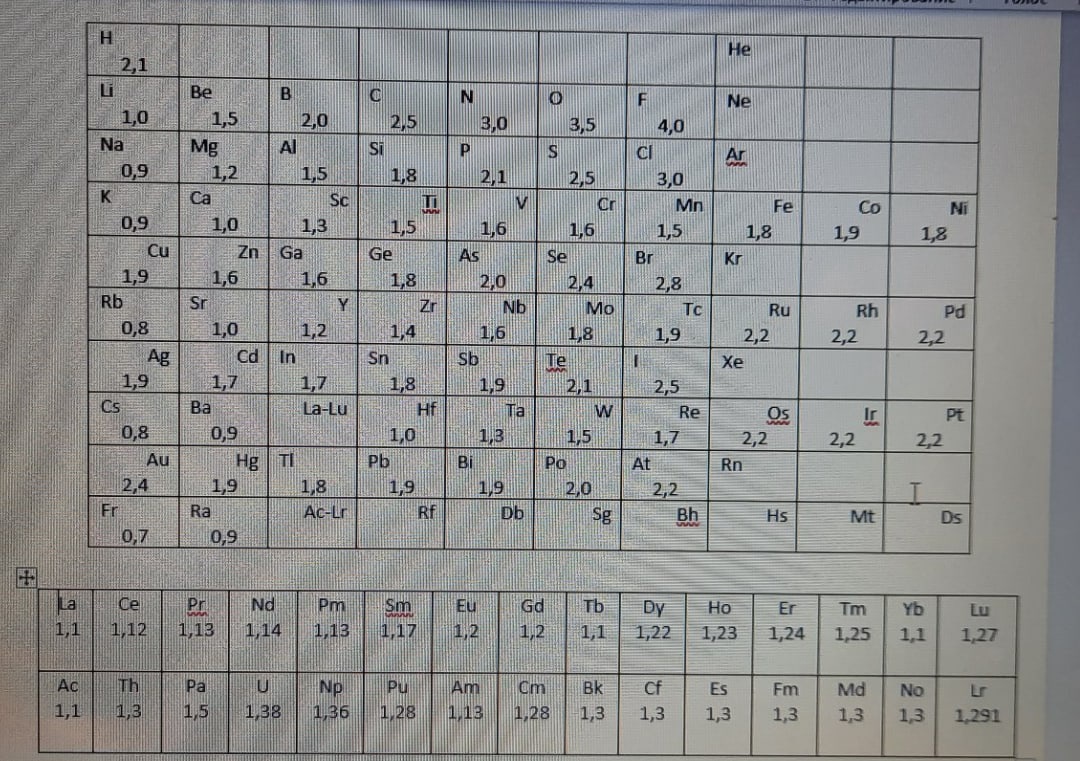
Электроотрицательность - способность притягивать к себе электроны при образовании связи. Чем больше ее значение, тем лучше атом "отбирает" электроны
у других атомов.
Ковалентная полярная связь - связь, которая показывает неравномерное распределение электронной плотности в молекуле, состоящей из атомов неметаллов.
На основе данного определения можно сделать вывод, что ковалентная полярная связь образуется между атомами разных элементов.
Чем больше разница электроотрицательностей элементов, тем больше полярность связи.
Например, рассмотрим связи H - S и H - F. Так как фтор - самый электроотрицательный элемент, то разница между электроотрицательностями F и H будет
больше, чем между S и H. Следовательно, связь H - F полярнее связи H - S.
Рассмотрим ещё один случай. У нас имеется связь H - P. Согласно шкале Полинга, электроотрицательно H равна 2,1. Пока всё нормально. Но тут мы видим,
что электроотрицательность P тоже равна 2,1! 2,1-2,1=0. Следовательно, по определению связь P - H ковалентная неполярная! Да, это так. Судя по этому
примеру, полярность связи нужно устанавливать только по разнице электроотрицательностей, а не по отношению атомов к какому-либо элементу.
Ионная связь - связь, образующаяся между заряженными частицами - ионами. Справедливо предположить, что 1 из частиц заряжена положительно, а другая -
отрицательно. Положительно заряженная частица - катион, а отрицательно заряженная частица - анион. Так как катион заряжен положительно, то он отдал электрон,
следовательно, до этого он был атомом металла. Анион наоборот: принял электрон катиона и стал заряжен отрицательно, следовательно, до этого он был атомом
неметалла. Такие выводы можно сделать на основе химии элементов: металлы легко отдают электроны, а неметаллы - легко принимают.
Естественно, атомы отдают и принимают определённое количество электронов, но как понять, какое конкретно?
На самом деле, все атомы стремятся приобрести структуру инертного газа, так как она наиболее устойчива. Этим объясняется то, что инертные газы не
взаимодействуют практически ни с какими веществами (только некоторые и с очень мощными окислителями). Также атомы стремятся сделать это наиболее
выгодым для себя способом, то есть с наименьшими затратами энергии, поэтому атомам металлов проще отдать электроны, так как их меньше всего, а
атомам неметаллов проще принять электроны, так как их надо мало для приобретения структуры инертного газа. Заряд иона равен тому количеству электронов,
которые необходимо принять или отдать.
Ионная связь присутствует в гидроксидах, кислотах и солях.
Металлическая связь - самая уникальная связь, ведь она имеет необычное строение.
Во-первых, связь образуется между атомами металла (с атомами одного элемента, а не разными, так как атомы металлов образуют друг с другом только сплавы!)
Во-вторых, внутри кристаллической решетки между атомами металла находится так называемый "электронный газ", который является скоплением электронов, ввшедших
за пределы атомов металлов. Из-за света эти электроны могут выводиться с фотонами, что можно наблюдать в виде металлического блеска.
У атомов водорода есть особенность, отличающая их от остальных элементов: атомы способны иметь слабое взаимодействие друг с другом, даже если электроны
или орбитали, доступные для образования связи, отсутствуют. Данный вид связи называется водородной. Данная связь очень выражена во льду, где атомы воды плотно
прижаты друг к другу, следовательно, водородным связям легче возникнуть. Также такие связи есть в цепочках ДНК и РНК. В ДНК между аденином и тимином (2 связи),
гуанином и цитозином (3 связи), а в РНК - между аденином и урацилом (2 связи) и гуанином и цитозином (3 связи).
Ван-дер-ваальсовы взаимодействия чем-то похожи на водородные связи, только их энергия меньше, а также они происходят не между атомами водорода. Такой
вид связи слабо изучен, поэтому данных о нём довольно мало. Можно предположить, что ван-дер-ваальсовы взаимодействия происходят между атомами инертных газов
несмотря на то, что они не взаимодействуют практически ни с какими другими атомами.