Так как предыдущий раздел был посвящен агрегатным состояниям веществ, было бы логичнее перейти сразу к разделу "Основные классы химических соединений",
однако там присутствует одна особенность - наличие уравнений химических реакций - поэтому необходимо узнать, что такое химические реакции и что они из себя
представляют, прежде чем переходить к следующему разделу.
Химические реакции - процесс превращения одних веществ в другие. В ходе него не меняются ядра атомов, а также число элементарных частиц остается неизменным,
поэтому химические реакции не относятся к физическим процессам, а представляют из себя химический процесс. В общем, смысл химических реакций заключается в
изменениях в электронной оболочке атомов.
Уравнения химических реакций - запись химической реакции. Уравнения химических реакций имеют свою стркутуру, которую необходимо разобрать для отсутствия
трудностей при дальнейшем изучении химии, ведь она построена на химических реакциях.
Для примера возьмем это уравнение:
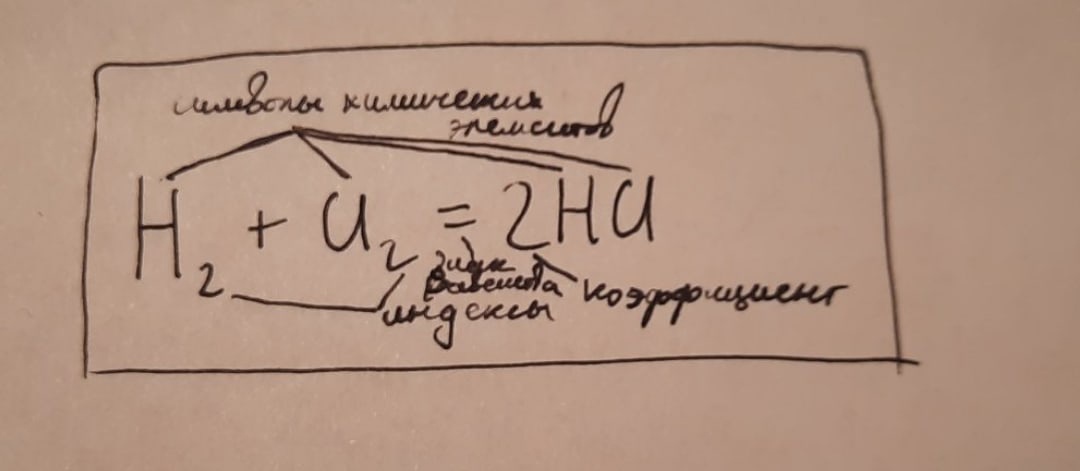
Разберем элементы, составляющие химическое уравнение
Знак элемента - символ, обозначающий данный элемент. Они берутся из таблицы Менделеева.
Индекс - число, стоящее справа от элемента, к которому относится, и немного ниже него.
Коэффициент - число молекул образовавшегося вещества.
Итак, вы познакомились со структурой химического уравнения, поэтому теперь можно переходить к классификации химических реакций.
На самом деле, существует довольно много видов классификации химических реакций, так как сложно придумать одну классификацию, ведь химические реакции довольно
универсальны и не похожи друг на друга. Итак, рассмотрим самые главные виды химических реакций по различным классификациям.
По числу образующихся продуктов химические реакции делят на реакции соединения, разложения, замещения и обмена.
Реакции соединения - реакции, при которых из несколько веществ образуется одно вещество.
Общая схема реакции соединения: A + B = C
Примеры реакций соединения:
2H2 + O2 = 2H2O
CaO + CO2 = CaCO3 (t)
Реакции разложения - реакции, при которых из одного вещества получается несколько веществ.
Общая схема реакции разложения: A = B + C
Примеры реакций разложения:
2KMnO4 = K2MnO4 + MnO2 + O2 (t)
NH4NO2 = N2 + 2H2O (t)
Реакции замещения - реакции, при которых из одного простого вещества и одного сложного вещества образуется другое простое вещество и другое сложное вещество.
Общая схема реакции замещения: A + BC = AC + B или A + BC = AB + C
Примеры реакций замещения:
2Al + 6HCl = 2AlCl3 + 3H2
Fe + Cu(NO3)2 = Fe(NO3)2 + Cu
Реакции обмена - реакции, при которых 2 сложных вещества обмениваются частями друг друга.
Общая схема реакции обмена: AB + CD = AD + BC
Примеры реакций обмена:
NaOH + HCl = NaCl + H2O
CuCl2 + 2AgNO3 = Cu(NO3)2 + 2AgCl
Логично, для химических реакций нужна энергия для совершения превращения. Она может заключаться или в самих веществах, или браться извне, поэтому реакции
делятся на экзотермические и эндотермические.
Экзотермические реакции - реакции, при которых происходит образование тепла. Чаще всего к ним относятся реакции соединения.
Общая схема экзотермических реакций: A + B = C + Q (Q - теплота) (схема может отличаться, но +Q всегда будет присутствовать)
Примеры экзотермических реакций:
2H2 (г) + O2 (г) = 2H2O (г) + 483,64 кДж
2Mg (тв) + O2 (г) = 2MgO (тв) + 1200 кДж
Эндотермические реакции - реакции, при которых происходит поглощение тепла. Чаще всего к ним относятся реакции разложения.
Общая схема эндотермических реакций: A = B + C - Q (схема может отличаться, но -Q всегда будет присутствовать)
Примеры эндотермических реакций:
N2 (г) + O2 (г) = 2NO (г) - 180,8 кДж
2H2O (г) = 2H2 (г) + O2 (г) - 483,64 кДж
По изменению степеней окисления бывают окислительно-восстановительные реакции (ОВР) и протолитические.
ОВР - реакции, при которых меняются степени окисления веществ. В данных реакциях всегда есть окислитель и восстановитель.
Окислитель - элемент, который окисляет восстановитель. В ходе ОВР степень окисления окислителя понижается.
Восстановитель - элемент, который восстанавливает окислитель. В ходе ОВР степень окисления восстановителя повышается.
Общей схемы ОВР нет, так как эти реакции довольно универсальны и почти непохожи друг на друга.
Примеры ОВР:
10KCl + 2KMnO4 + 8H2SO4 = 6K2SO4 + 2MnSO4 + 5Cl2 + 8H2O
В данной реакции окислителем является Mn+7 (KMnO4), а восстановителем - Cl-1 (KCl)
K2CrO4 + H2SO4 + H2S = S + Cr2(SO4)3 + K2SO4
+ H2O
Протолитические реакции - реакции, при которых не меняется степень окисления элементов.
У этого вида химических реакций также нет общей схемы, так как они универсальны.
Примеры протолитических реакций:
K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
NaCl + AgNO3 = AgCl + NaNO3
По агрегатному состоянию реагирующих веществ химических реакций делятся на гомогенные и гетерогенные.
Гомогенные реакции - химические реакции, в которых реагенты находятся в одном агрегатном состоянии. К таким реакциям относятся взаимодействия газ-газ и
жидкость-жидкость.
Примеры гомогенных реакций:
2SO2 (г) + O2 (г) = 2SO3 (г)
NaOH (ж) + HCl (ж) = NaCl (ж) + H2O (ж)
Гетерогенные реакции - реакции, в которых реагенты находятся в разных агрегатных состояниях. К таким реакциям относятся взаимодействия газ-жидкость, газ-
твердое вещество, жидкость-твердое вещество, твердое вещество-твердое вещество.
Примеры гетерогенных реакций:
2NaOH (ж) + CO2 (г) = Na2CO3 (ж) + H2O (ж)
2Ca (тв) + O2 (г) = 2CaO (тв)
В зависимости от природы реагирующих веществ реакции делятся на обратимые и необратимые.
Обратимые реакции - реакции, которые могут протекать в обратном направлении. В обратимых реакциях вместо "=" ставятся стрелки, направленные в разные стороны.
Примеры обратимых реакций:
H2O + C = CO + H2
2SO2 + O2 = 2SO3
Необратимые реакции - реакции, которые не могут протекать в обратном направлении. Это происходит чаще всего из-за образования осадка и выделения осадка в ходе
прямой реакции.
Примеры необратимых реакций:
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O - здесь образуется белый осадок сульфата бария BaSO4, поэтому
данная реакция является необратимой.
Na2CO3 + 2HCl = 2NaCl + H2O + CO2 - здесь выделяется углекислый газ CO2, поэтому реакция необратима.
Некоторые химические реакции протекают очень медленно, поэтому для ускорения их протекания используются катализаторы, а другие реакции могут проходить и
без этого, поэтому химические реакции делятся на каталитические и некаталитические.
Каталитические реакции - реакции, для которых используется катализатор.
Катализатор - вещество, которое повышает скорость химической реакции, но не участвует в ней.
Из определения катализатора следует, что он не расходуется в химической реакции. Это можно объяснить, написав схему каталитических реакций:
A + B = AB - реакция, для которой используется катализатор
A + K = AK, AK + B = AB + K - ход реакции после добавления катализатора
Из этой схемы можно сделать вывод, что катализатор всё же участвует в химических реакциях, ввиду чего образуются побочные продукты, которые в итоге превращаются в
требуемый продукт реакции. Из схемы также следует, что исходная и конечная массы катализаторов равны (это видно по коэффициентам в уравнениях реакций), поэтому
кажется, что катализатор не участвует в реакции, ведь его масса не поменялась.
Примеры каталитических реакций:
4KClO3 = KCl + 3KClO4 - данная реакция идет только в присутствии катализатора, при нагревании реакция будет иметь вид: KClO3 = KCl + O2
N2 + 3H2 = 2NH3 - реакция Габера-Боша, которая идет в присутствии катализатора, высокой температуры и давления.
Некаталитические реакции - реакции, которые могут идти без присутствия катализатора.
Примеры некаталитических реакций:
H2 + F2 = 2HF - реакция идет даже без присутствия света.
2NaH + H2O = 2NaOH + H22 - из-за высокой активности гидридов реакция идет без присутствия катализаторов.