Для того, чтобы хорошо ориентироваться в химии, обязательно необходимо знать номенклатуру химических соединений в неорганической химии, ведь в ней мы
постоянно сталкиваемся с названиями различных соединений, которые необходимо знать. Заучить их все нереально, поэтому нужно вывести закономерность
названий соединений в неорганической химии.
Номенклатура соединений - совокупность названий всех химических соединений и их классов. Стоит отметить, что в химическую номенклатуру входят не только
названия различных веществ, но и правила их составления, которые будут рассмотрены далее.
Номенклатура классов соединений - совокупность названий классов веществ, обладающих похожими свойствами. Всего основных классов соединений в неорганической
химии 6: металлы, неметаллы, оксиды, гидроксиды, кислоты и соли. Они будут рассмотрены подробнее в разделе "Основные классы соединений"
Для того, чтобы получились названия оксидов и гидроксидов, надо сказать "оксид/гидроксид" и название элемента в Родительном падеже. Например, BaO - оксид
бария, Ba(OH)2 - гидроксид бария.
Для того, чтобы получилось название металла/неметалла, надо найти его в таблице Менделеева.
Способы образования названий кислот и солей будут рассмотрены далее.
Стоит также отметить, что в том случае, когда элемент может иметь несколько степеней окисления, в скобках ставится его валентность в данном соединении
(римские цифры). Например, FeO - оксид железа (II), Fe(OH)2 - гидроксид железа (II), ClO2 - оксид хлора (IV).
К сожалению, названия кислот придется учить. Они приведены в таблице ниже.
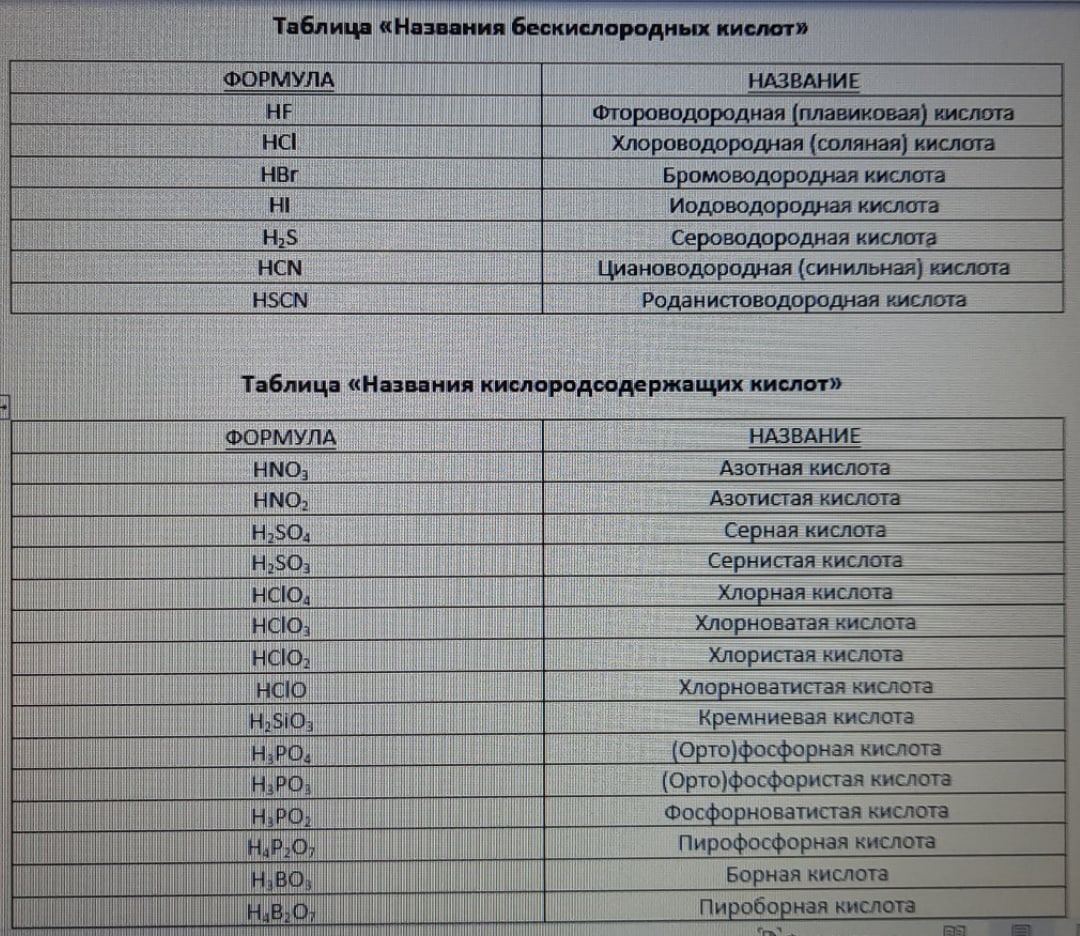
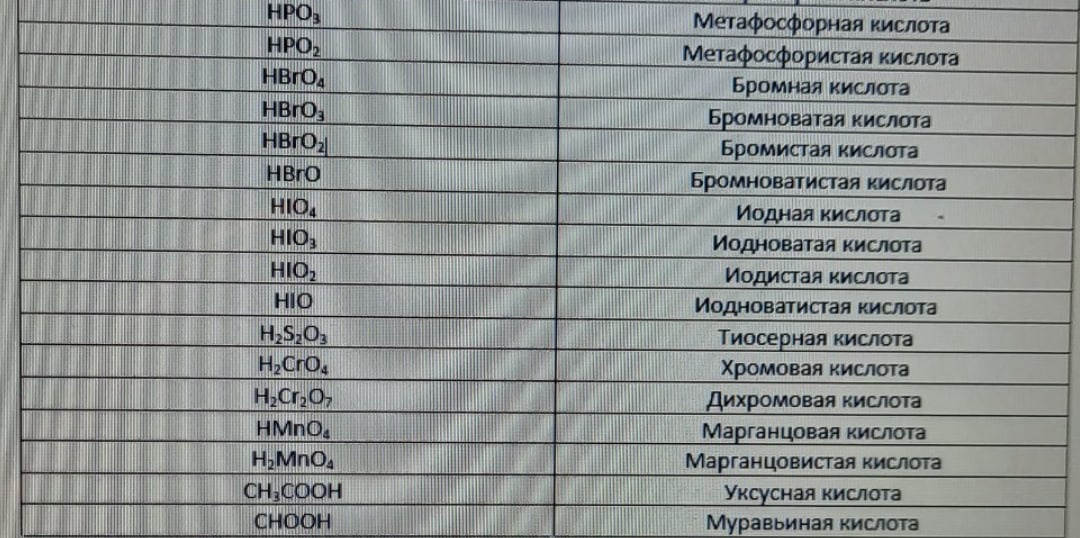
Несмотря на это, существует номенклатура для названия кислот, образованных элементом, который может иметь разные степени окисления.
Возьмём в качестве примера кислоты H2SO4 и H2SO3. Кислота, в которой сера принимает наибольшую степень окисления -
H2SO4. Это серная кислота. В H2SO
необходимо к названию серной кислоты добавить суффикс -ист-. Тогда получится название: "сернистая кислота".
Но что делать в том случае, если у элемента есть больше степеней окисления и, следовательно, он образует больше кислот? Это происходит в случаях с HClO, HClO2,
HClO3 и HClO4.
Так как в кислоте HClO4 степень окисления хлора наивысшая (+7), то кислота имеет название без суффиксов: хлорная кислота. В HClO3 степень
окисления хлора немного ниже (+5), однако здесь будет добавляться не суффикс -ист-, а суффиксы -ов- и -ат-. Получается хлорноватая кислота. В HClO2
степень окисления хлора еще ниже (+3), поэтому сюда уже будет прибавляться суффикс -ист-. Получается хлористая кислота. И, наконец, рассмотрим HClO. В данной
кислоте хлор принимает наименьшую степень окисления (+1), поэтому сюда будет прибавляться сразу 3 суффикса: -ов-, -ат- и -ист-. Получается хлорноватистая кислота.
Номенклатура солей чем-то напоминает номенклатуру кислот, ведь названия солей зависят от названия кислоты, чей кислотный остаток они имеют. Названия всех
кислотных остатков приведены в таблице ниже.
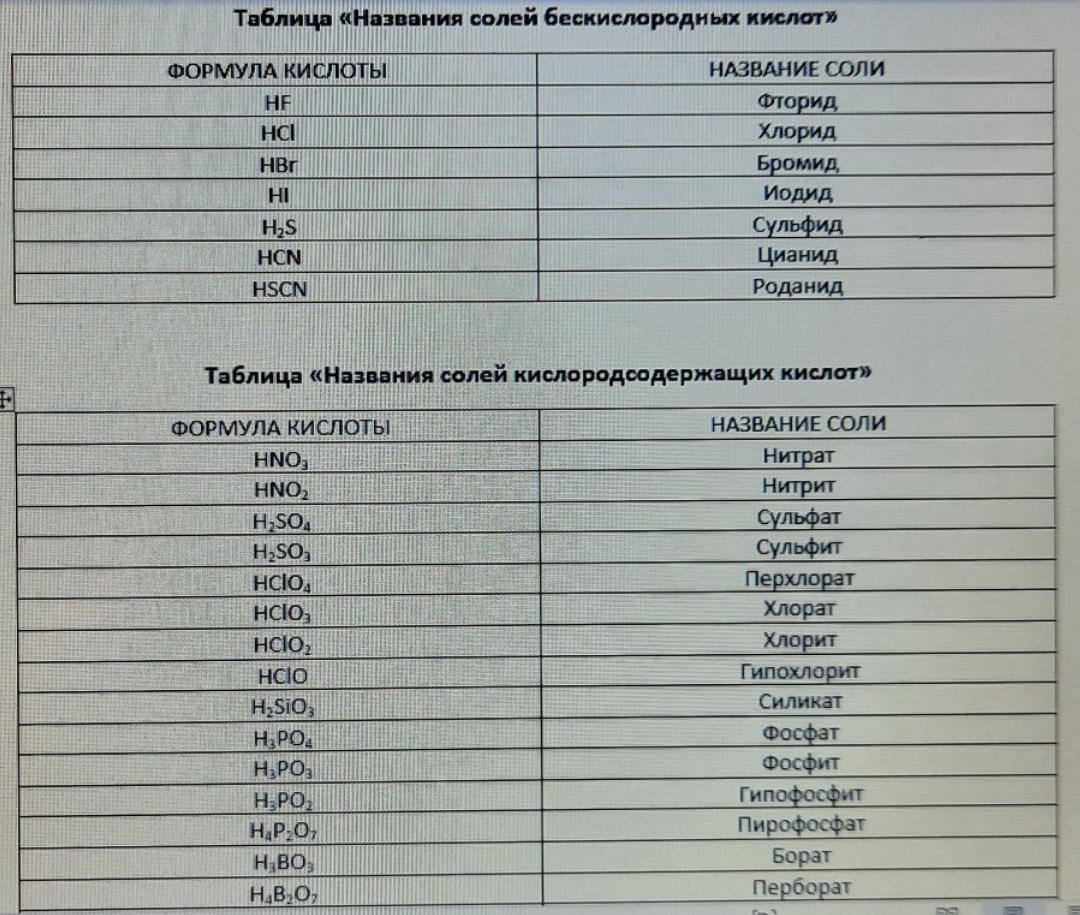
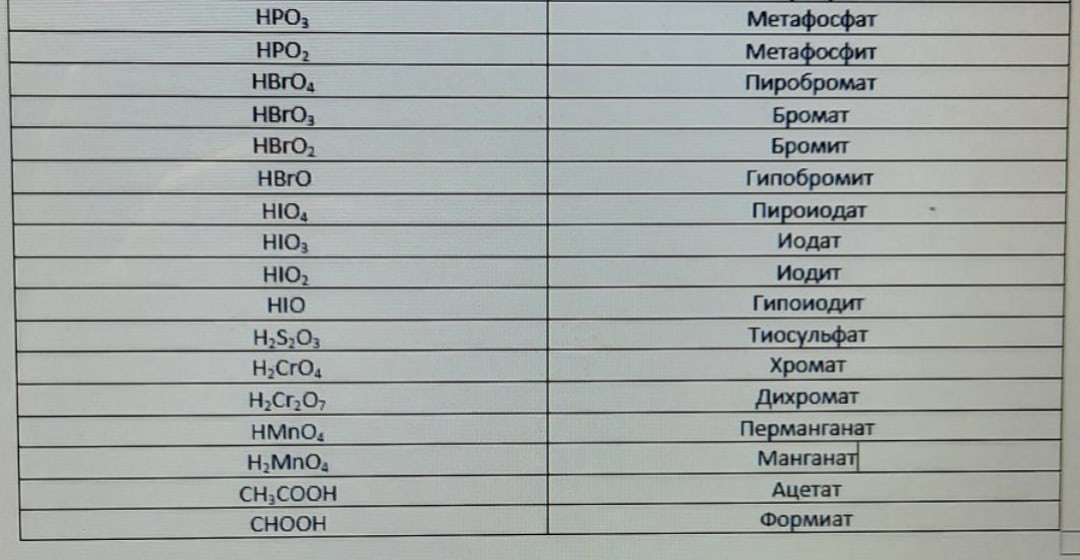
Здесь также прослеживается закономерность. Если кислота, характерная для данного элемента, одна, то в названии соли есть суффикс -ат-. Если элемент образует
2 кислоты, то названия солей сильных кислот имеют суффикс -ат-, а слабых - -ит-. Но что происходит, если имеется больше кислот?
Вернемся к рассмотрению HClO, HClO2, HClO3 и HClO4. Здесь необходимо провести границу между сильными и слабыми кислотами.
Она проходит между хлористой и хлорноватой кислотами. HClO3 уже является сильной кислотой, следовательно, соли этой кислоты - хлораты.
Противоположная ситуация у HClO2. Соли этой кислоты называются хлоритами. Все самое интересное начинается при рассмотрении HClO4 и HClO.
Если есть 2 сильных кислоты, 1 из которых чуть слабее другой, то к названию кислотного остатка менее сильной кислоты прибавляется приставка пер-. То есть соли
хлорной кислоты - перхлораты. Существует похожее правило и для слабых кислот. Если есть 2 слабых кислоты, 1 из которых чуть сильнее другой, то к названию
кислотного остатка более сильной кислоты прибавляется приставка гипо-. То есть соли хлорноватистой кислоты - гипохлориты.
Однако вышеприведенная номенклатура подходит только для средних солей. Но что с остальными типами солей?
Для начала рассмотрим кислые и основные соли.
Чтобы получилось название кислой соли, необходимо перед названием кислотного остатка поставить гидро-. Например, NaHCO3 - гидрокарбонат натрия,
Ba(HSO3)2 - гидросульфит бария.
Чтобы получилось название основной соли, необходимо перед названием кислотного остатка поставить гидроксо-. Например, [Cu(OH)]2CO3 -
гидроксокарбонат меди (II) (малахит), [Fe(OH)]SO3 - гидроксосульфит железа (II).
Названия двойных солей образуются по такому же принципу, как и названия средних солей. Например, NaAlO2 - алюминат натрия.
Теперь необходимо рассмотреть способ образования названий комплексных солей.
Перед тем, как составлять название комплексной соли, необходимо определить, чем представлены комплексные частицы в ней. Далее необходимо посмотреть, чему равен
индекс, стоящий после формулы комплексной частицы, и по этой цифре добавить к названию частицы составляющую.

(цифры, отн. к част.)
Далее необходимо добавить ко всей этой конструкции суффикс -ат-, а затем написать название элемента, стоящим первым в формуле, в Родительном падеже.
В качестве примера возьмем [Cu(NH3)4](OH)2. Здесь комплексной частицей является аммиак NH3, следовательно,
соль - аммиакат. Далее смотрим, сколько аммиака в соли: его 4, следовательно, соль - тетрааммиакат. Элемент, стоящий первый в формуле - медь ->
тетрагидроксоаммиакат меди. Но мы забыли про OH группу. Так как она здесь есть, то название будет - гидроксид тетрааммиаката меди (II).
В качестве еще одного примера возьмем Na[Al(OH)4]. Здесь комплексной частицей является [Al(OH)4]-. Следовательно, соль -
тетрагидроксоалюминат натрия.
По сути, номенклатура соединений, содержащих более или менее 2 элементов, уже рассмотрена, поэтому необходимо рассмотреть номенклатуру бинарных соединений
в целом, ведь помимо оксидов есть и множество других бинарных соединений.
Для того, чтобы получилось название бинарного соединения, необходимо взять элемент, который стоит на последнем месте в формуле записи соединения. Необходимо
взять его название на латинском языке, а в нем найти корень, который будет составляющей частью названия. Затем к корню надо добавить суффикс -ид-. В конце надо
написать название элемента, который стоит первым в формуле соединения, в Родительном падеже.
В качестве примера рассмотрим Na3N. Азот по-латински - Nitrogenium. Так как на -genium заканчивается довольно много элементов в латинском языке, то корнем
здесь является -Nitr-, его и возьмем. Получается нитр. Добавляем суффикс -ид- и получаем нитрид. В конце осталось написать название элемента в Родительном падеже.
Итак, Na3N - нитрид натрия.