Вернуться на стартовую страницу
Энергетические уровни
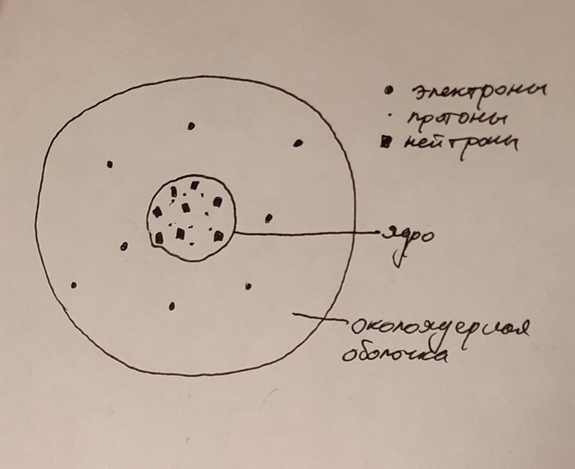
Атом - не мельчайшая частица, так как она состоит из более мелких деталей,
которые будут рассмотрены далее.
На данном рисунке в качестве примера взят атом кислорода. Здесь видно,
что атом состоит из ядра, околоядерного пространства, а также из частиц:
протонов, нейтронов и электронов. На самом деле, этих частиц гораздо больше
(больше 100), однако для их рассмотрения необходимо хорошо знать физику и
химию, а также быть готовым к очень большому объему информации, поэтому здесь
будет рассматриваться только основная информация.
Ядро - "сердце" атома, ведь оно находится в его центре. В ядре хранятся протоны, нейтроны и другие частицы, поэтому на ядро приходится 90% массы атома.
Следовательно, наличие ядра в атоме очень важно.
Околоядерная оболочка - то, что окружает ядро. В ней находятся электроны, которые хаотично летают внутри атома. Также эта часть атома важна тем, что
благодаря ней можно узнать, сколько энергетических уровней есть в атоме данного элемента.
.
В атоме находится большое количество частиц: свыше 100. Однако основными из них являются протоны, электроны и нейтроны, поэтому внимание будет уделено им.
Протон - положительно заряженная частица, находящаяся в ядре атома. Заряд этой частицы условно принят за +1, хотя на самом деле он равен 1,602^10(-19) Кл.
Несмотря на то, что атом имеет очень маленький размер и его невозможно увидеть через микроскоп, все же можно посчитать число протонов в нем. Оно равно
порядковому номеру элемента.
Электрон - отрицательно заряженная частица, которая находится в околоядерной оболочке. Его заряд условно равен -1, а реальный противоположен заряду
протона: -1,602^ 10(-19) Кл. Число электронов равно числу протонов.
Нейтрон - частица, содержащаяся в ядре и имеющая заряд, равный 0. Число нейтронов также можно посчитать по формуле: число нейтронов = A - z, где
A - абсолютная атомная масса, z - порядковый номер элемента
Атом - на первый взгляд простая вещь, ведь она небольшая и имеет не слишком богатое строение. Несмотря на это, на его точное установление ушло более
1000 лет!
Впервые представление об атоме ввел Демокрит. Он считал, что в мире есть только атомы и пустота. Также он думал, что всё состоит из атомов. Гипотеза
Демокрита подтвредилась только спустя 1000 лет, потому что в то время, к сожалению, еще не было технологий, благодаря которым это могло бы подтвердиться.
Гипотеза подтвердилась Джоном Дальтоном в 1800-е годы. Когда это произошло, начали выдвигаться модели строения атома, о которых будет рассказано далее.

Данная модель была выдвинута Джозефом Томсоном и его братом одной из первых, в 1904 году
В модели атом представляет из себя огромную положительно заряженную массу, внутрь которой помещены отрицательно заряженные частицы. При таком описании
проводится аналогия с пудингом с изюмом, поэтому модель братьев Томсонов иногда называют так.
.
.
.
.
.
.
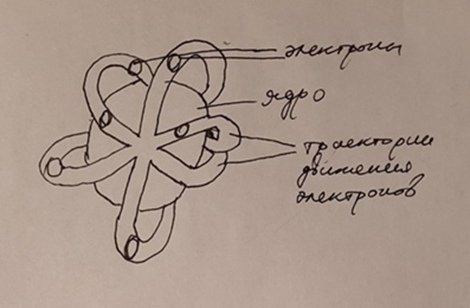
Предложена соответственно Эрнстом Резерфордом в 1911 году. Другое название модели - ядерная, так как здесь в строении атома появляется ядро, в отличие
от модели Томсонов.
На изображении видно, что ядро имеет положительный заряд, а вокруг него в атоме размазан отрицательный. На самом деле, так оно и есть, но ядерная
модель строения атома имела и некоторые нюансы. Во-первых, электроны не движутся таким образом вокруг атома, а образуют энергетически уровки, которые
в данной модели не отражены. Во-вторых, при движении электрон должен падать на ядро из-за действия на него сил трения и уменьшения скорости его движения.
.
.
.
.

Модель была предложена Нильсом Бором в 1913 году. Другое ее название - планетарная, так как Бор считал, что в атоме электроны движутся вокруг ядра,
как планеты вокруг Солнца: имеют свою постоянную траекторию движения.
К сожалению, гипотеза была опровергнута, так как было выяснено, что электроны движутся хаотично.
.
.
.
.
.
.

Предложена в 1924 году. Другое название модели - волновая, так как в ней предполагается, что электроны - волны, а не частицы.
К сожалению, и эта теория со временем была отвергнута, так как выяснилось, что электрон имеет корпускулярно-волновые свойства, то есть обладает как
свойствами частицы, так и свойствами волны.
.
.
.
.
.
.
Вернуться на стартовую страницу Энергетические уровни