В мире химии содержится огромное количество химических соединений. Все они имеют разные названия и строение. Однако среди них можно выделить основные
классы веществ, которые обладают важными свойствами и распространены в мире в больших количества.
Между соединениями разных классов существует генетическая связь, которая дает представление об их химических свойствах. Она приведена ниже.
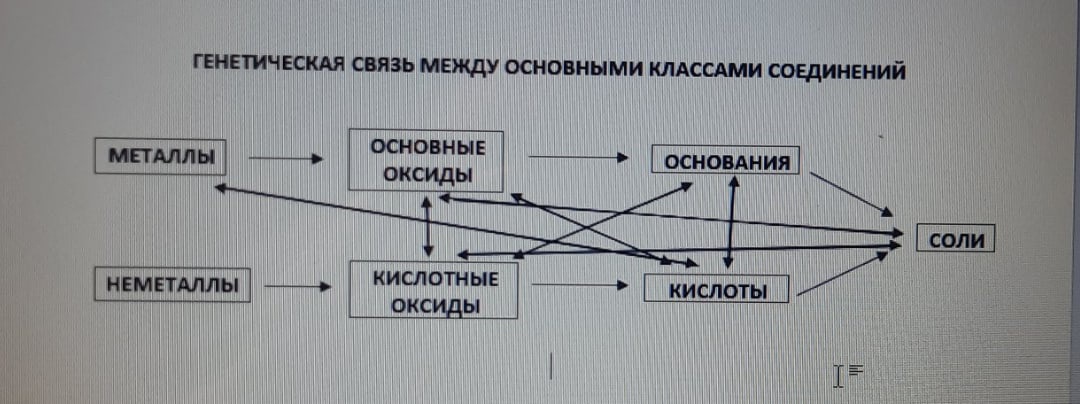
Итак, дана схема. Вроде всё понятно, однако всё же необходимо дать пояснения по ней.
Во-первых, почему классы соединений расположены именно в таком порядке? Ответ довольно прост. В начале расположены классы, благодаря которым существуют
следующие за ними классы. Все классы соединений существуют благодаря металлам и неметаллам. Их необходимо поместить друг под другом, так как они и соединения,
которые они образуют, обладают разными, дополняющими друг друга свойствами. Далее идут оксиды металлов (основные) и оксиды неметаллов (кислотные). Логично,
что благодаря ним существуют основания, кислоты и соли. Далее идут, естественное, основания и кислоты, а в конце стоят соли. Они находятся "между рядами",
так как соли являются производными как оснований, так и кислот, поэтому их тяжело отнести к одному из рядов, и это было бы неправильно.
Во-вторых, что же означают стрелки на схеме? Они показывают, какие классы соединений могут взаимодействовать друг с другом. По картинке вы сами можете
догадаться, что это за классы.
Итак, таблица генетической связи между основными класссами соединений является одной из ключевых в неорганической химии, так как благодаря ней легко
усваиваются базовые знания в данной области, что очень важно для дальнейшей работы с углубленным материалом. Самое главное преимущество - легкое понимание
химических свойств различных классов соединений.
Если вы полностью разобрались в таблице, у вас нет никаких вопросов и вы готовы приступить дальше, прокручивайте данную страницу вниз: здесь вы найдете
химические свойства всех основных классов соединений.
Металлы - простые вещества, внутри которых связь между атомами является металлической. Из этого определения следует, что металлы обладают металлическим
блеском ввиду наличия внутри их кристаллических решёток так называемого "электронного газа", о котором было рассказано в главе "Взаимодействия атомов друг
с другом".
Металлы делят на различные группы по их расположению в таблице Менделеева. Металлы бывают щелочные (элементы, находящиеся в 1 группе главной подгруппе),
щелочно-земельные (элементы. находящиеся во 2 группе главной подгруппе, начиная с Ca), переходные (металлы, которые находятся в побочных подгруппах).
1) Металлы реагируют с неметаллами при нагревании. При этом могут образовываться различные соединения.
Общая схема реакции: Металл + Неметалл = МеталлНеметалл (t)
Примеры химических реакций:
Mg + S = MgS (t), - сульфид магния.
3Ca + 2P = Ca3P2 (t) - фосфид кальция (III).
2) Металлы реагируют с кислородом при нагревании, образуя основные оксиды.
Общая схема реакции: Металл + O2 = Основный оксид (t)
Примеры химических реакций:
2Mg + O2 = 2MgO (t) - оксид магния.
4Li + O2 = 2Li2O (t) - оксид лития.
3) Металлы вытесняют металлы, стоящие после них в ряду напряжения металлов, из их солей при нагревании. Образуются соль и металл.
Общая схема реакции: Металл1 + Соль1 = Соль2 + Металл2 (t)
Примеры химических реакций:
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu (t) - сульфат алюминия и медь
Na + AlCl3 = - реакция не пойдет, так как для щелочных и щелочно-земельных металлов это нехарактерно.
Cu + Fe(NO3)3 = - реакция не пойдет, так как медь стоит правее железа в ряду напряжения металлов.
4) Металлы при реакции с галогенами и серой образуют соль. С некоторыми веществами реакция идет при нагревании, а с некоторыми может начаться просто так.
Общая схема реакции: Металл + Галоген = Галогенид, Металл + S = Сульфид
Примеры химических реакций:
2Fe + 3F2 = 2FeF3 - фторид железа (III). Так как фтор - сильный окислитель, то реакция будет идти без нагревания.
2Na + Cl2 = 2NaCl (t) - хлорид натрия (поваренная соль). Реакция идет уже при нагревании.
Fe + S = FeS (t) - сульфид железа (II). Сера - слабый окислитель, следовательно, железо окисляется до степени окисления +2, а не +3.
Fe + I2 = FeI2 - иодид железа (II). Так как иод как окислитель слабее фтора, железо окисляется до +2, а не +3.
5) Металлы реагируют с водой, образуя различные продукты в зависимости от активности металла.
5.1) Активные металлы реагируют с водой с образованием щелочи и водорода.
Общая схема химической реакции: Me + H2O = Me(OH)x + H2
Примеры химических реакций:
2Na + 2H2O = NaOH + H2 - гидроксид натрия (каустическая сода, едкий натр) и водород.
Ba + 2H2O = Ba(OH)2 + H2
5.2) Металлы средней активности реагируют с водой с образованием оксида и выделение водорода при нагревании.
Общая схема химической реакции: Me + H2O = MexOy + H2 (t)
Примеры химических реакций:
Zn + H2O = ZnO + H2 (t)
2Al + 3H2O = Al2O3 + 3H2 (t)
5.3) Малоактивные металлы не реагируют с водой.
Неметаллы - простые вещества, внутри которых связь между атомами является ковалентной полярной. Из этого определения следует, что связи в атомах неметаллов
равнозначны. Также следует то, что электроны находятся на своих местах, так как из-за большого количества валентных электронов их тяжело отщепить от атомов
неметаллов, поэтому проще присоединить еще электроны для образования конфигурации инертного газа и при этом затратить небольшое количество энергии, что
является более выгодным для атомов.
1) Неметаллы реагируют с металлами при нагревании. При этом могут образовываться различные соединения. Примеры реакций смотрите в разделе "Металлы"
2) Неметаллы реагируют с кислородом при нагревании, образуя кислотные оксиды.
Общая схема реакции: Неметалл + O2 = Кислотный оксид (t)
Примеры химических реакций:
4P + 5O2 = 2P2O5 (t) - оксид фосфора (V).
S + O2 = SO2 (t) - оксид серы (IV) (сернистый газ).
Так как неметаллы довольно универсальны, то лучше всего рассматривать отдельные вещества при изучении химии неметаллов.
Оксиды - бинарные соединения, в которых одним из элементов является кислород, имеющий степень окисления, равную "-2".
Оксиды бывают нескольких видов. Их классификация приведена в таблице ниже:
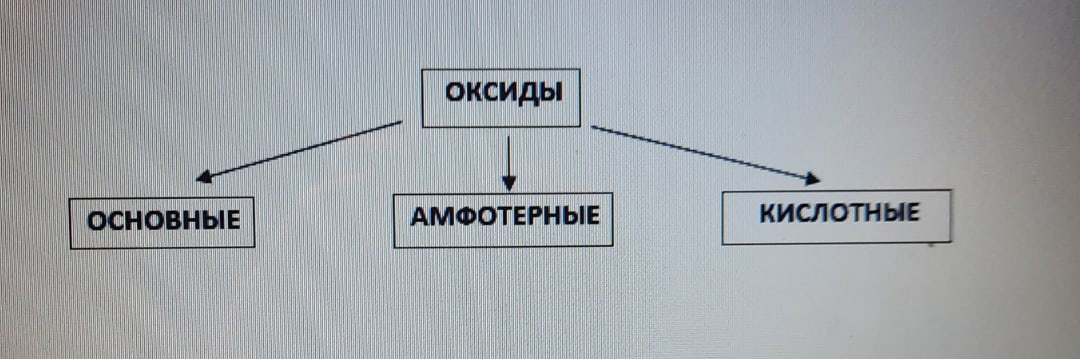
Солеобразующие оксиды - оксиды, которые при взаимодействии с другими веществами могут образовывать соль (если данный продукт предусмотрен в реакции).
Также данные оксиды являются продуктами разложения соответствующих кислот или оснований.
Основные оксиды - оксиды, в состав которых помимо кислорода входит атом металла со степенью окисления +1 или +2. Из этого правила, конечно же, есть
исключения. Их надо запомнить. Это ZnO, и.
Основные оксиды могут реагировать с некоторыми металлами и неметаллами, амфотерными и кислотными оксидами, кислотами, солями. Химические свойства
всех солеобразующих оксидов будут рассмотрены далее.
1) При разложении основных оксидов образуются металл и кислород (естественно, реакция идет при нагревании).
Общая схема реакции: Основный оксид = Металл + O2 (t)
Примеры химических реакций:
2Al2O3 = 4Al + 3O2 (t) - алюминий и кислород
2Ag2O = 4Ag + O2 (t) - еребро и кислород
2) При гидратации основных оксидов образуются основания.
Общая схема реакции: Основный оксид + H2O = Основание
Примеры химических реакций:
CaO + H2O = Ca(OH)2 - гидроксид кальция (гашеная известь)
BaO + H2O = Ba(OH)2 - гидроксид бария
3) Основные оксиды реагируют с кислотными оксидами при нагревании, образуя соль.
Общая схема реакции: Основный оксид + Кислотный оксид = Соль (t)
Примеры химических реакций:
CaO + SO2 = CaSO3 (t) - сульфит кальция
BaO + CO2 = BaCO3 (t) - карбонат бария
4) Основные оксиды реагируют с кислотами. Образуются соль и вода.
Общая схема реакции: Основный оксид + кислота = Соль + H2O
Примеры химических реакций:
5) Основные оксиды реагируют с амфотерными оксидами. При этом образуется соль, получаемая только в результате сплавления.
Общая схема реакции: Основный оксид + Амфотерный оксид = Соль
Примеры химических реакций:
Na2O + Al2O3 = 2NaAlO2 (t) - алюминат натрия
CaO + ZnO = CaZnO2 (t) - цинкат кальция
6) Основные оксиды реагируют с амфотерными гидроксидами. При этом образуется комплексная соль.
Общая схема реакции: Основный оксид + Амфотерный гидроксид = Комплексная соль
Примеры химических реакций:
Na2O + 2Al(OH)3 + H2O = 2Na[Al(OH)4] - тетрагидроксоалюминат натрия
K2O + Zn(OH)2 + H2O = K2[Zn(OH)4] - тетрагидроксоцинкат калия
Кислотные оксиды - оксиды, в состав которых входит атом со степенью окисления +5, +6 или +7.
1) При разложении кислотных оксидов образуются неметалл и кислород. Реакция идет при нагревании.
Общая схема реакции: Кислотный оксид = Неметалл + O2 (t)
Примеры химических реакций:
2) При гидратации кислотных оксидов получаются кислоты.
Общая схема реакции: Кислотный оксид + H2O = Кислота
Примеры химических реакций:
SO3 + H2O = H2SO4 - серная кислота
N2O5 + H2O = 2HNO3 - азотная кислота
3) Кислотные оксиды реагируют с основными оксидами. Смотрите примеры реакций в разделе "Основные оксиды".
4) Кислотные оксиды реагируют с основаниями. При этом образуются соль и вода.
Общая схема реакции: Кислотный оксид + Основание = Соль + H2O
Примеры химических реакций:
SO2 + 2NaOH = Na2SO3 + H2O - сульфит натрия и вода
SiO2 + 2KOH = K2SiO3 + H2O - силикат калия и вода
5) Кислотные оксиды реагируют с солями при нагревании. Менее летучие кислотные оксиды вытесняют более летучие.
Общая схема реакции: Соль1 + Кислотный оксид1 = Соль2 + Кислотный оксид2
Примеры химических реакций:
Na2CO3 + SiO2 = Na2SiO3 + CO2 - силикат натрия и углекислый газ
K2SO3 + N2O5 = 2KNO3 + SO2 - нитрат калия и сернистый газ
6) Кислотные оксиды реагируют с амфотерными оксидами при нагревании. Образуется соль.
Общая схема реакции: Кислотный оксид + Амфотерный оксид = Соль (t)
Примеры химических реакций:
3SO3 + Al2O3 = Al2(SO4)3 (t) - сульфат алюминия
P2O5 + 3ZnO = Zn3(PO4)2 (t) - фосфат цинка
Амфотерные оксиды - оксиды, в состав которых входит атом со степенью окисления +3 или +4. Зачастую это так, однако есть исключения, рассмотренные в
разделе "Основные оксиды", которые, несмотря на отличность от определения, также являются амфотерными оксидами.
Амфотерные оксиды необычны тем, что они в различных ситуациях могут проявлять свойства как основных, так и кислотных оксидов, поэтому они имеют довольно
большое количество химических свойств.
1) При разложении амфотерных оксидов образуются металл и кислород.
Общая схема реакции: Амфотерный оксид = металл + O2 (t)
Примеры химических реакций:
2Al2O3 = 4Al + 3O2 (t) - алюминий и кислород
2ZnO = 2Zn + O2 (t) - цинк и кислород
2) Амфотерные оксиды реагируют с основными оксидами. Реакции смотрите в разделе "Основные оксиды"
3) Амфотерные оксиды реагируют с кислотными оксидами так же, как и основные оксиды. Смотрите примеры реакций в разделе "Кислотные оксиды".
4) Амфотерные оксиды реагируют с основаниями. При этом образуется комплексная соль при нагревании.
Общая схема реакции: Амфотерный оксид + Основание = Комплексная соль
Примеры химических реакций:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] - тетрагидроксоцинкат натрия
Al2O3 + 2KOH + 3H2O = 2K[Al(OH)4] - тетрагидроксоалюминат калия
5) Амфотерные оксиды реагируют с кислотами так же, как и основные оксиды.
Общая схема реакции: Амфотерный оксид + Кислота = Соль + H2O
Примеры химических реакций:
ZnO + H2SO4 = ZnSO4 + H2O - образуются сульфат цинка и вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O - хлорид алюминия и вода
6) Амфотерные оксиды реагируют с солями летучих кислот.
Общая схема реакции: Амфотерный оксид + Соль1 = Соль2 + Кислотный оксид
Примеры химических реакций:
ZnO + Na2CO3 = Na2ZnO2 + CO2 - цинкат натрия и углекислый газ
Cr2O3 + K2SO3 = KCrO2 + SO2 - хромит калия и сернистый газ
Несолеобразующие оксиды - оксиды неметаллов, которые при реакции с другими оксидами не образуют солей. Таких оксидов 4: SiO, N2O, NO, CO.
Гидроксиды - вещества, состоящие из атомов металла и гидроксильной группы OH, имеющую заряд "-1". Число OH-групп равно степени окисления металла.
Гидроксиды также имеют свою классификацию:
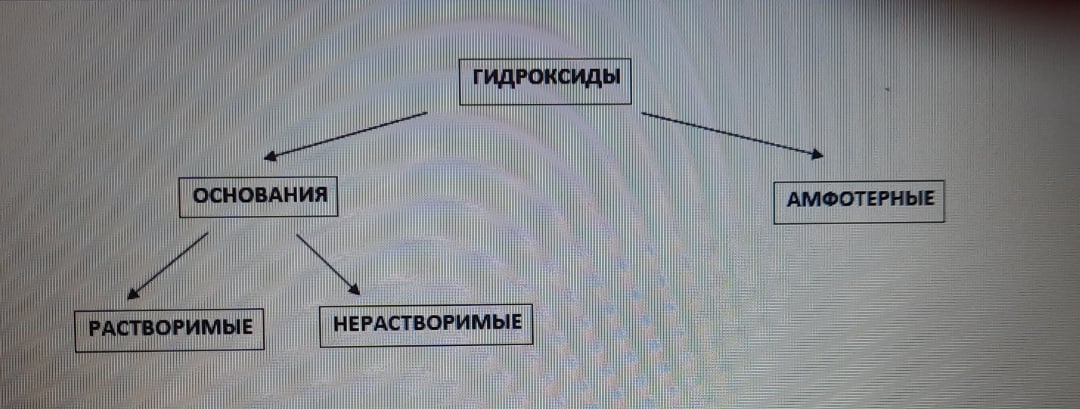
Однокислотный гидроксид - гидроксид, содержащий 1 OH-группу, двухкислотный гидроксид - гидроксид, содержащий 2 OH-группы и т.д.
Итак, предагаю рассмотреть подробнее 1 классификацию.
Основания - гидроксиды, которые обладают основными свойствами. Существует несколько видов оснований: растворимые и нерастворимые. Рассмотрим химические свойства
всех этих видов оснований.
Щелочи - растворимые в воде основания. Они обладают довольно выраженными основными свойствами.
1) Щелочи реагируют с кислотными оксидами. Образуются соль и вода.
Общая схема реакции: Щелочь + Кислотный оксид = Соль + H2O
Примеры химических реакций:
2NaOH + SO2 = Na2SO3 + H2O - сульфит натрия и вода
2KOH + CO2 = K2CO3 + H2O - карбонат калия и вода
2) Щелочи реагируют с кислотами. Образуются соль и вода. Реакция основания с кислотой - реакция нейтрализации.
Общая схема реакции: Щелочь + Кислота = Соль + H2O
Примеры химических реакций:
2NaOH + H2SO4 = Na2SO4 + 2H2O - сульфат натрия и вода
KOH + HCl = KCl + H2O - хлорид калия и вода
3) Щелочи реагируют с амфотерными гидроксидами. Образуется комплексная соль.
Общая схема реакции: Щелочь (избыток) + Амфотерный гидроксид = Комплексная соль
Примеры химических реакций:
NaOH + Al(OH)3 = Na[Al(OH)4] - тетрагидроксоалюминат натрия
2KOH + Zn(OH)2 = K2[Zn(OH)4] - тетрагидроксоцинкат калия
4) Щелочи реагируют с амфотерными оксидами. Смотрите примеры реакций в разеделе "Амфотерные оксиды".
5) Щелочи реагируют с растворимыми солями. Образуется нерастворимое основание и соль.
Общая схема реакции: Щелочь + Соль1 = Основание + Соль2
Примеры химических реакций:
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 - образуются осадок гидроксид меди (II) голубого цвета и сульфат натрия
2KOH + MgS = K2S + Mg(OH)2 - гидроксид магния и сульфид калия
Нерастворимые основания - нерастворимые в воде основания.
1) Нерастворимые основания разлагаются на основный оксид и воду.
Общая схема реакции: Нерастворимое основание = Основный оксид + H2O
Примеры химических реакций:
Cu(OH)2 = CuO + H2O - оксид меди (II) и вода
Fe(OH)2 = FeO + H2O - оксид железа (II) и вода
2) Нерастворимые основания реагируют с кислотами, образуя соль и воду.
Общая схема реакции: Нерастворимое основание + Кислота = Соль + H2O
Примеры химических реакций:
Cu(OH)2 + 2HCl = CuCl2 + H2O - хлорид меди (II) и вода
Fe(OH)2 + 2HI = FeI2 + H2O - иодид меди (II) и вода
Амфотерные гидроксиды - гидроксиды, обладающие основными свойствами.
1) Амфотерные гидроксиды взаимодействуют с кислотными оксидами. Смотрите примеры реакций в разделе "Кислотные оксиды".
2) Амфотерные гидроксиды взаимодействуют с избытком щелочей. Смотрите примеры реакций в разделе "Щелочи".
3) Амфотерные гидроксиды реагируют с кислотами. Образуются соль и вода. Этот случай относится к реакциям нейтрализации.
Общая схема реакции: Кислота + Амфотерный гидроксид = Соль + H2O
Примеры химических реакций:
6HCl + 2Al(OH)3 = 2AlCl3 + 3H2O - хлорид алюминия и вода
3H2SO4 (разб.) + 2Cr(OH)3 = Cr2(SO4)3 + 6H2O
- сульфат хрома (III) и вода
4) Амфотерные гидроксиды разлагаются на амфотерный гидроксид и воду.
Общая схема реакции: Амфотерный гидроксид = Амфотерный оксид + H2O (t)
Примеры химических реакций:
2Al(OH)3 = Al2O3 + 3H2O (t) - оксид алюминия и вода
Zn(OH)2 = ZnO + H2O (t) - оксид цинка и вода
Кислоты - вещества, состоящие из атомов водорода и кислотного остатка. Число атомов водорода равно заряду кислотного остатка.
У кислот есть несколько видов классификации.
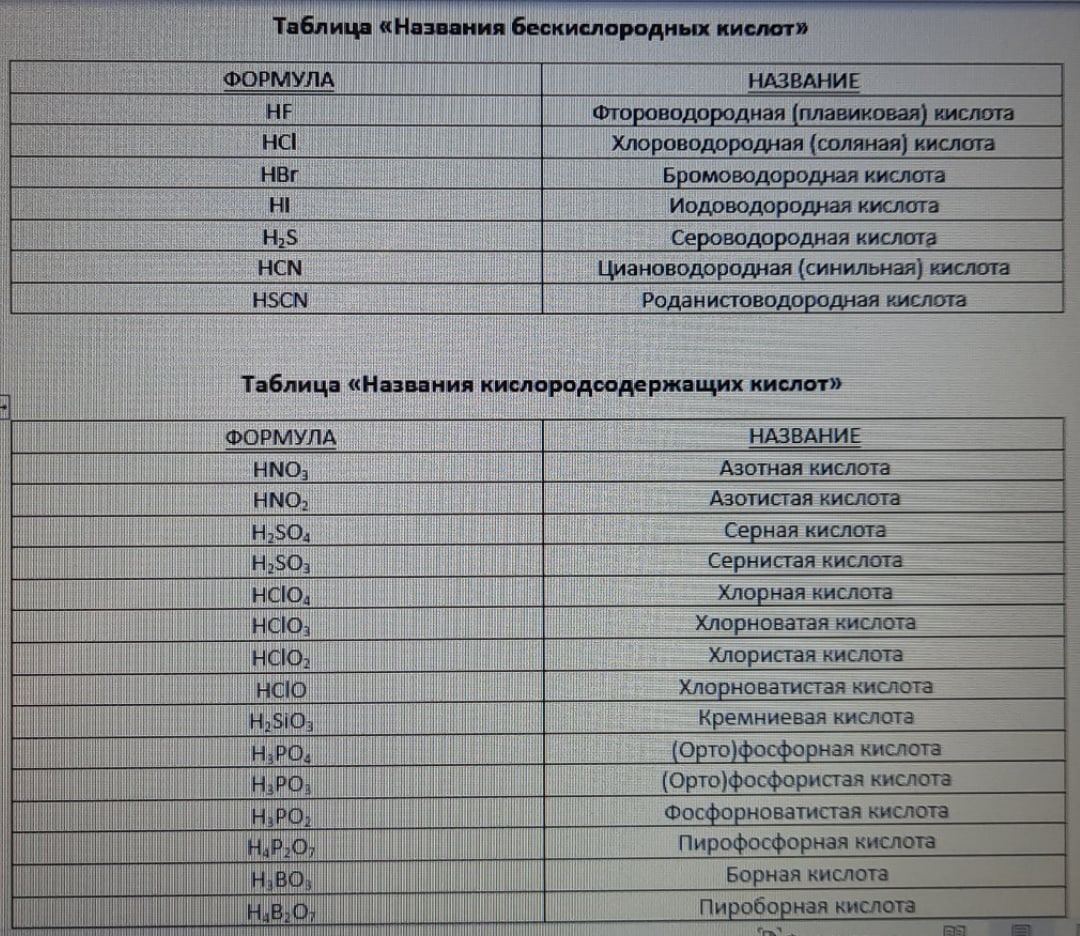
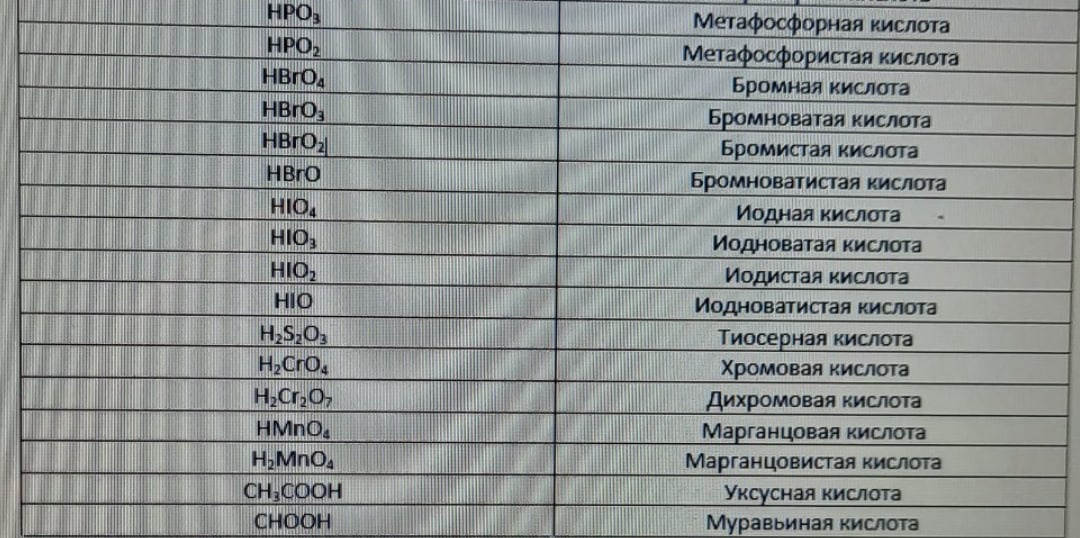
Бескислородные кислоты - кислоты, в молекулах которых отсутствуют атомы кислорода. Например, HCl, HBr и т.п.
Кислородсодержащие кислоты - кислоты, в молекулах которых присутствуют атомы кислорода. Например, H2SO4, HNO3 и т.п.
Одноосновная кислота - кислота, содержащая 1 атом водорода, двухосновная кислота - кислота, содержащая 2 атома водорода и т. д.
1.1) При разложении кислородсодержащих кислот образуются вода и кислотный оксид.
Общая схема реакции: Кислота = Кислотный оксид + H2O (t)
Примеры химических реакций:
H2SO4 = H2O + SO3 (t)
H2SiO3 = H2O + SiO2
1.2) При разложении бескислородных кислот выделяется водород и образуется неметалл.
Общая схема реакции: Кислота = H2 + Неметалл (t)
Примеры химических реакций:
2HCl = H2 + Cl2 (t) - водород и хлор
H2S = H2 + S (t) - водород и сера
2) Кислоты реагируют с основными оксидами. Смотрите примеры реакций в разделе "Основные оксиды".
3) Кислоты реагируют с амфотерными оксидами. Смотрите примеры реакций в разделе "Амфотерные оксиды".
4) Кислоты реагируют с основаниями. Смотрите примеры реакций в разделе "Щелочи".
5) Кислоты реагируют с амфотерными гидроксидами. Смотрите примеры реакций в разделе "Амфотерные гидроксиды".
6) Кислоты реагируют с солями, если образуется нерастворимый в воде осадок, выделяется газ или образуется малодиссоциирующее вещество.
Общая схема реакции: Кислота + Соль = Нерастворимый осадок + Соль (в случае с образованием H2SiO3) / Кислота
Примеры химических реакций:
2H3PO4 + 3BaCl2 = Ba3(PO4)2 + 6HCl - образуется осадок (фосфат бария).
2HF + SrCl2 = SrF2 + 2HCl - образуется осадок (фторид стронция).
7) Все кислоты, кроме HNO3, реагируют с металлами, выделяя водород. Образуются соль и водород.
Общая схема реакции: Кислота + Металл = Соль + H2
Примеры химических реакций:
H2SO4 (разб.) + 2Na = Na2SO4 + H2 - сульфат натрия и водород
2HI + Ca = CaI2 + H2 - иодид кальция и водород
Соли - вещества, которые состоят из атома металла и кислотного остатка. То есть соли являются производными данного основания и данной соли.
Однако данное определение солей не слишком верное, ведь соли также бывают разных видов, каждый из которых будет рассмотрен далее.

Средние соли - соли, который состоят из катиона и аниона. Например, Na2CO3, KCl.
Кислые соли - соли, которые состоят из катиона и аниона с ионами водорода, образующие новый кислотный остаток. Например, NaHCO3, NaHS.
Основные соли - соли, которые состоят из аниона и катиона с гидроксид-ионами, образующие новый катион. Например, [Cu(OH)]2CO3,
[Fe(OH)]SO3.
Двойные соли - соли, которые состоят из 2 катионов. Например, KAl(SO4)2, MgZn(NO3)4.
Смешанные соли - соли, которые состоят из 2 анионов. Например, Ca(ClO)Cl, Na2ClBr.
Комплексные соли - соли, которые содержат в себе комплексные частицы. Например, Na[Al(OH)]3, [Cu(NH3)4](OH)2.
1) Соли диссоциируют на катионы и анионы.
Общая схема реакции: Соль = Катион + Анион
Примеры химических реакций:
CaCl2 = Ca2+ + 2Cl-
NaNO3 = Na+ + NO3-
2) Соли летучих кислот реагируют с амфотерными оксидами. Смотрите примеры реакций в разделе "Амфотерные оксиды".
3) Соли реагируют с кислотными остатками. Смотрите примеры реакций в разделе "Кислотный оксиды".
4) Соли реагируют с кислотами. Смотрите примеры реакций в разделе "Кислоты".
5) Растворимые соли реагируют с щелочами. Смотрите примеры реакций в разделе "Щелочи".
6) 2 растворимые соли взаимодействуют друг с другом. Образуются 2 другие соли, одна из которых нерастворимая.
Общая схема реакции: Соль1 + Соль2 = Соль3 + Соль4
Примеры химических реакций:
Na2S + CuCl2 = 2NaCl + CuS - образуются сульфид меди (II) черного цвета и хлорид натрия
AgNO3 + KCl = AgCl + KNO3 - образуются белый творожистый осадок хлорид серебра и нитрат калия
7) Соли взаимодействуют с металлами. Смотрите примеры реакций в разделе "Металлы".
8) Соли разлагаются на основный и кислотный оксиды.
Общая схема реакции: Соль = Основный оксид + Кислотный оксид (t)
Примеры химических реакций:
CaSO3 = CaO + SO2 (t) - оксид кальция и оксид серы (IV)
K2CO3 = K2O + CO2 - оксид калия и углекислый газ